Попередня сторінка: Спирти: класифікація, ізомерія та номе...
Наступна сторінка: Обчислення за хімічними рівняннями, я�...
Пригадайте: водневий зв'язок — це особлива міжмолекулярна взаємодія, що реалізується за рахунок притягання атомів Гідрогену однієї молекули води до атома Оксигену іншої.
Фізичні властивості спиртів
Серед спиртів немає газуватих речовин. Перші члени гомологічного ряду насичених одноатомних спиртів — це рідини, а вищі спирти (від C15) — тверді речовини. У гомологічному ряду нормальних (нерозгалужених) спиртів зі збільшенням молекулярної маси підвищуються температури плавлення й кипіння (як і в алканів), а густина спиртів майже не змінюється (табл. 8). Перші три члени гомологічного ряду змішуються з водою необмежено, а далі розчинність суттєво зменшується. Тверді спирти не мають запаху, тоді як рідким властиві специфічні запахи. При цьому метанол та етанол за запахом дуже схожі й відрізнити їх майже неможливо.
Таблиця 8. Фізичні властивості насичених одноатомних спиртів

Вплив водневого зв'язку на фізичні властивості спиртів
Зверніть увагу, що в ряду насичених одноатомних спиртів, на відміну від насичених і ненасичених вуглеводнів, немає газуватих речовин, хоча перші члени ряду мало відрізняються від них за молекулярною масою. Це пояснюється тим, що атоми Оксигену в молекулах спиртів сполучені з атомами Гідрогену, і в них є неподілена електронна пара (як у молекул води). Тобто у спиртів та води подібна електронна будова молекул:

Це зумовлює можливість утворення водневого зв’язку між молекулами спиртів. Завдяки водневому зв’язку молекули спиртів, так само як і молекули води, асоційовані: між ними існує додаткова міжмолекулярна взаємодія:

Утворенням водневих зв’язків між молекулами спиртів і молекулами води пояснюється розчинність нижчих спиртів (табл. 8).
Молекули спиртів складаються ніби з двох частин — розчинної у воді (гідрофільної), що містить гідроксильну групу, та нерозчинної (гідрофобної), що складається з вуглеводневого залишка. Якщо вуглеводневий залишок невеликий, то водневі зв’язки гідроксильної групи з молекулами води спроможні втримати молекулу спирту в розчині. Якщо ж молекула спирту має довгий вуглеводневий ланцюг, який «чинить опір» розчиненню, то гідроксильна група вже не в змозі здійснити розчинення речовини. Тому вищі спирти — нерозчинні.
Хімічні властивості насичених одноатомних спиртів
Для спиртів найбільш характерні реакції за участі групи —OH:
• окиснення до альдегідів або карбонових кислот;
• дегідратація (внутрішньо- або міжмолекулярна);
• гідрогенгалогенування;
• взаємодія з дуже активними металами.
1. Окиснення. Для спиртів, як і для вуглеводнів, характерне повне та часткове окиснення.
Повне окиснення — горіння — відбувається під час взаємодії з киснем, у результаті чого утворюються вуглекислий газ і вода:

Як і вищі вуглеводні, вищі спирти горять кіптявим полум’ям унаслідок неповного згоряння, під час якого утворюється чадний газ або вуглець (сажа).
Під час часткового окиснення спиртів утворюються альдегіди або карбонові кислоти залежно від реагентів та каталізаторів, що застосовуються для взаємодії.
Під час пропускання спиртів над розпеченим мідним або мідно-срібним каталізатором спирти втрачають водень та перетворюються на альдегіди:

Також спирти перетворюються на альдегіди або карбонові кислоти під час взаємодії з різними окисниками (калій дихромат, калій перманганат, кисень тощо).

Демонстраційний дослід: окиснення етанолу купрум(іі) оксидом
У промисловості під час окиснення спиртів киснем на мідному каталізаторі суміш випарів спирту з киснем пропускають крізь розпечену мідь. Реакція відбувається у дві стадії:


У лабораторії цей процес можна відтворити поетапно. Прожарюємо мідний дріт у полум'ї пальника (а), у результаті чого мідь взаємодіє з киснем. Спостерігаємо, що червона поверхня міді вкривається чорним нальотом купрум(іі) оксиду.
Далі розпечений дріт занурюємо в пробірку з етанолом (б). Спостерігаємо, що поверхня дроту знов стає червоною, а в пробірці з'являється запах оцтового альдегіду. Сумарно реакцію окиснення етанолу можна записати так:

Пригадайте: минулого року під час вивчення окисно-відновних реакцій на прикладі міді та купрум(іі) оксиду ви аналізували суть процесів окиснення та відновлення. В органічній та біологічній хімії під окисненням розуміють процеси, що призводять до втрати молекулою атомів Гідрогену або приєднання нею атомів Оксигену. Відновлення, навпаки,— це процеси, пов'язані з приєднанням атомів Гідрогену або втратою атомів Оксигену.

Мал. 14.1. Дегідратація спиртів: нагрівання етанолу із сульфатною кислотою (а).
Знебарвлення бромної води під час пропускання утвореного газу доводить, що одержана речовина є ненасиченою (б)
2. Дегідратація. Процес відщеплення молекули води називають дегідратацією. Під час нагрівання спиртів з концентрованою сульфатною кислотою відбувається відщеплення молекул води від молекул спиртів. Але залежно від температури, за якої відбувається реакція, можлива внутрішньомолекулярна або міжмолекулярна дегідратація.
Внутрішньомолекулярна дегідратація. Під час нагрівання вище за 160 °C молекула води відщеплюється від однієї молекули спирту, й утворюється алкен (мал. 14.1).
У загальному вигляді схема реакції:
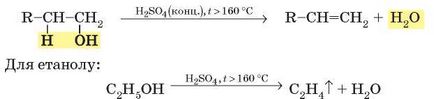
Під час дегідратації спиртів, у яких група -OH приєднана не до першого атома Карбону, можливі два напрямки реакції:

У таких випадках реакція відбувається переважно за напрямком I: атом Гідрогену відщеплюється від найменш гідрогенізованого атома Карбону (з яким сполучене менше атомів Гідрогену). Таку закономірність помітив учень Бутлерова О. М. Зайцев (правило Зайцева).
Міжмолекулярна гідратація. Якщо температура близько 140 °С, молекула води відщеплюється від двох молекул спирту з утворенням етерів. Наприклад, діетиловий етер, або медичний ефір, добувають за такою схемою:

У даному випадку концентрована сульфатна кислота є не тільки каталізатором, але й водовідіймаючим засобом — речовиною, що активно поглинає воду в ході хімічних або фізико-хімічних процесів.
Діетиловий етер уперше було добуто за цією реакцією ще в XVI столітті. Тоді вважали, що в його складі міститься Сульфур, тому його назвали сірчаним ефіром. Цю назву іноді застосовують і сьогодні.
3. Взаємодія з гідроген галогенідами. За наявності концентрованої сульфатної кислоти спирти взаємодіють з гідроген галогенідами (HCl, HBr, HI).
У загальному вигляді схема реакції:

У цій реакції сульфатна кислота також є не тільки каталізатором, а й сприяє відщепленню води, тобто є водовідіймаю-чим засобом.
За таких умов реакція відбувається тільки зі спиртами, в яких група -OH з’єднана з кінцевим атомом Карбону (такі спирти називають первинними).

4. Взаємодія з лужними металами.
За звичайних умов спирти вступають у реакцію заміщення з активними металами, зокрема лужними, з утворенням солей (алконолятів) та водню (мал. 14.2). У загальному вигляді схема реакції:

Ця реакція є прикладом виявлення кислотних властивостей спиртів. Але дисоціація спиртів у водному розчині настільки незначна (менша за дисоціацію води), що кислотами спирти назвати не можна. Спирти не змінюють забарвлення індикаторів і не взаємодіють з лугами.

Одержання етанолу
1. Спиртове бродіння глюкози. Більшу частину етанолу одержують з глюкози або інших вуглеводів. Дією ферментів, що виділяють дріжджі, молекули глюкози розщеплюються на молекули етанолу та вуглекислого газу:

Цей процес дуже поширений у природі й широко використовується людиною. Вуглекислий газ, що виділяється під час бродіння, розпушує дріжджове тісто. Під час бродіння соку ягід чи фруктів утворюється етиловий спирт, що використовують для виготовлення вина та інших напоїв.
В Україні виробництво спирту є державною монополією і відбувається на близько 40 заводах концерну «Укрспирт» в усіх регіонах України. Загальна потужність усіх заводів ДП «Укрспирт» становить понад 360 млн л на рік, а найбільше його виробляють у Вінницькій області.
2. Гідратація етену. Гідратацію етену ви вже вивчали як хімічну властивість етену:
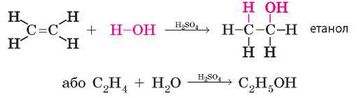
Зверніть увагу, що і для гідратації, і для дегідратації необхідна сульфатна кислота. Але гідратація відбувається за наявності порівняно розбавленого розчину кислоти, і кислота є тільки каталізатором, а дегідратація — за наявності концентрованого розчину, і кислота також є водовідіймаючим засобом.
Біопаливо
Сьогодні у світі дедалі більше етанолу використовують як пальне для автомобілів. Спирт для цього добувають ферментацією зернових й інших сільськогосподарських культур (просо, цукрова тростина, соя, кукурудза тощо).
Такий етанол називають біоетанолом, або біопаливом, оскільки його добули не з викопних ресурсів, а з рослинної сировини.
Використання біоетанолу сприяє зменшенню викидів вуглекислого газу в атмосферу: під час згоряння етанолу виділяється вуглекислий газ, що потім засвоюється рослинами, з яких знову добувають етанол. У такий спосіб підтримується колообіг вуглекислого газу без включення до нього додаткової кількості вуглекислого газу від згоряння викопного палива. У деяких автомобільних двигунах використовують чистий етанол. Але частіше його додають до звичайного бензину в різних пропорціях, таку суміш можна використовувати у будь-якому автомобілі. В Україні від 2014 року законодавчо встановлено вміст етанолу в бензині на рівні 7 %. Але на деяких заправках також продають пальне з умістом етанолу 30-40 %. Автомобільне пальне зі значним умістом біоетанолу позначають буквою Е.
Ключова ідея
На фізичні властивості спиртів суттєво впливає водневий зв'язок, що може
утворюватися і між молекулами спиртів, і між молекулами спиртів та води.
Більшість хімічних властивостей спиртів зумовлені наявністю гідроксильної
групи -OH.
Контрольні запитання
199. Схарактеризуйте фізичні властивості спиртів. Поясніть вплив водневого зв'язку на фізичні властивості спиртів.
200. Як у гомологічному ряду насичених одноатомних спиртів змінюється: а) агрегатний стан за звичайних умов; б) температура кипіння; в) розчинність у воді; г) розчинність у бензені?
201. Поясніть, чому спирти не змінюють забарвлення індикаторів.
202. Схарактеризуйте хімічні властивості та методи одержання спиртів. Складіть відповідні рівняння хімічних реакцій на прикладі етанолу.
Завдання для засвоєння матеріалу
203. Складіть рівняння реакцій для перетворень:

204. Складіть рівняння реакції: а) дегідратації пропан-1-олу; б) реакції про-пан-1-олу з бромоводнем. За яких умов відбувається ця реакція?
205. Складіть рівняння реакцій для здійснення перетворень за схемами:

Комплексні завдання
206. Обчисліть об'єм водню (н. у), що виділиться під час дії металічного калію на метанол масою 24 г.
207. Обчисліть об'єм етену (н. у.), що можна добути з етанолу масою 11,5 г. Яку масу бромної води з масовою часткою брому 2 % можна знебарвити цією кількістю газу?
208. Обчисліть масу солі, що утворюється під час взаємодії натрію з етанолом масою 23 г.
209. Під час взаємодії метанолу з надлишком натрію виділився водень об'ємом 2,24 л (н. у.). Обчисліть масу спирту, що вступив у реакцію.
210. Під час взаємодії натрію з розчином етанолу в бензені масою 200 г виділився водень об'ємом 56 мл (н. у.). Обчисліть масову частку спирту в цьому розчині.
211. Складіть рівняння реакцій горіння метанолу, етанолу й пропанолу. У скільки разів будуть розрізнятися об'єми газуватих продуктів реакції, отриманих під час горіння цих спиртів?
212. Обчисліть об'єм гідроген броміду, необхідного для взаємодії з етанолом масою 11,5 г.
213. Обчисліть об'єм кисню, необхідний для згоряння: а) 230 г етанолу; б) 5 моль метанолу.
214. Дегідратацією етанолу було добуто 0,448 л етену (н. у.). Обчисліть масу спирту, що вступив у реакцію.
215. Під час взаємодії одноатомного спирту масою 3,7 г з натрієм виділився водень об'ємом 560 мл (н. у.). Визначте молекулярну формулу спирту.
216. Під час спалювання одноатомного насиченого спирту кількістю речовини 0,1 моль було витрачено 10,08 л кисню (н. у.). Визначте молекулярну формулу цього спирту.
217. Метанол у промисловості добувають реакцією сполучення карбон(ІІ) оксиду з воднем. Складіть рівняння цієї реакції. Обчисліть об'єм водню, необхідний для взаємодії з 500 л чадного газу. Яку масу метанолу при цьому можна добути?
Завдання з розвитку критичного мислення
218. Складіть схему перетворень, за якою можна добути етанол з кальцій карбіду. Складіть відповідні рівняння реакцій.
219. Як ви вважаєте, у який спосіб реалізується водовідіймаюча дія речовин: кальцій оксиду, кальцій хлориду (безводного), сульфатної кислоти (концентрованої), фосфор(У) оксиду? В якому випадку від-
бувається хімічна взаємодія (яка саме), а в якому — фізико-хімічна (яка саме)? Чи впливає на це можливість утворення молекулами водневого зв'язку?
220. Що ми спостерігатимемо, якщо наллємо невелику порцію метанолу в склянку: а) з водою, б) октаном? Відповідь поясніть.
221. На практиці реакцію спиртів з гідроген галогенідами проводять в умовах якомога меншої кількості води в реакційній суміші. Для цього в колбі змішують концентровану сульфатну кислоту, спирт і галогенід. Складіть рівняння реакції добування бромоетену з етанолу, калій броміду та сульфатної кислоти.
222. Використовуючи значення електронегативностей елементів, порівняйте полярність зв'язків C-H і O-H. Молекули яких речовин — спиртів чи вуглеводнів — більш полярні? Як це позначається на фізичних властивостях цих речовин?
223. Спирти практично не проводять електричного струму, тоді як луги, що також містять гідроксильну групу, у розплавленому стані або у водному розчині проводять електричний струм. Чим це можна пояснити?
224. Як ви вважаєте, чим можна пояснити, що спирти виявляють слабкі кислотні властивості?
Це матеріал з підручника Хімія 10 клас Григорович
Наступна сторінка: Обчислення за хімічними рівняннями, я�...